تأثير عمليات سحب الأوراق العلمية التي مردها أخطاء غير مقصودة على الباحثين
19 February 2025
نشرت بتاريخ 5 فبراير 2025
أكثر من 100 تجربة إكلينيكية تختبر فاعلية علاجات قائمة على الخلايا الجذعية في حقل الطب التجديدي، ما يمثل طفرة في هذا المجال الذي يحيطه جدل أخلاقي وسياسي.
Credit:Åsa Sjöström for Nature
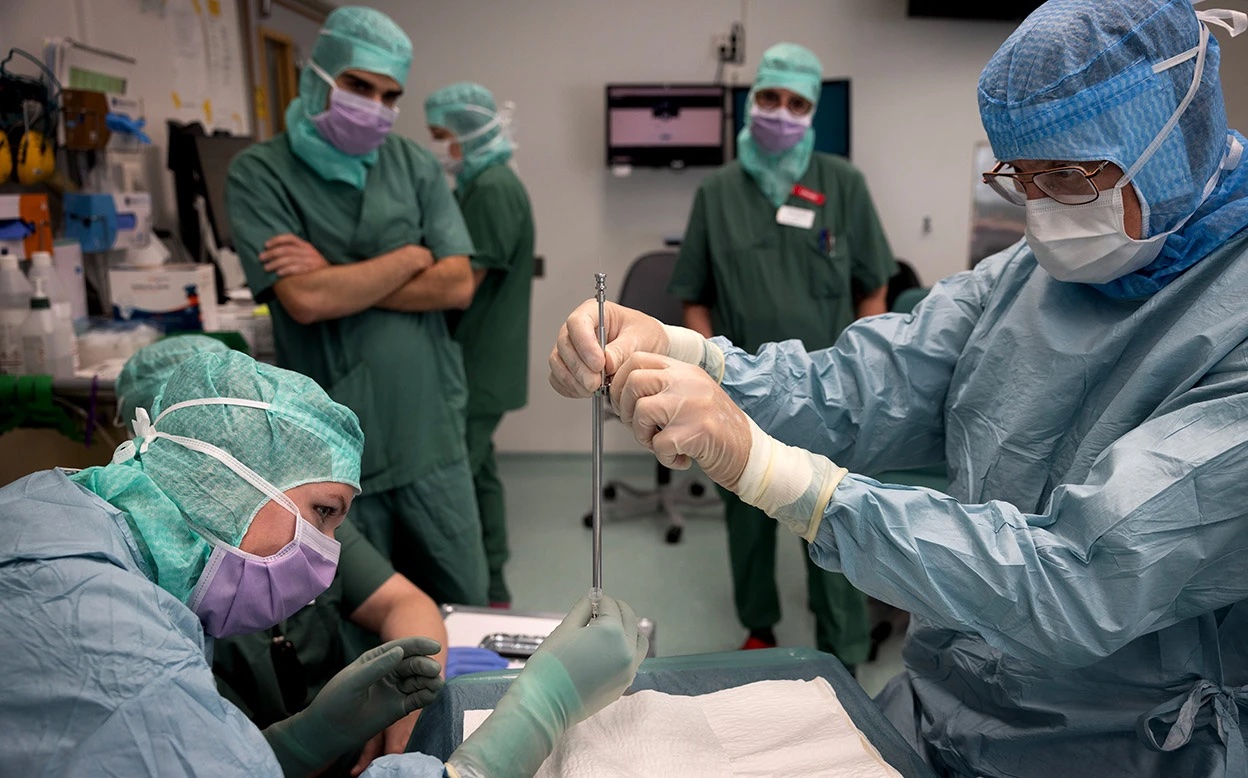
أمضى آندرو كاسي حياته المهنية في العمل بقسم لأبحاث الاتصالات عن بعد، إلى أن اضطُر إلى التقاعد مبكرًا بسبب تشخيصه بالإصابة بداء «باركنسون» في عام 2010. ولما ساوره الفضول حيال مرضه، الذي بات يرى أنه يشبه معضلة هندسية، قرر التطوُع للمشاركة في تجارب إكلينيكية لمعرفة كنهه.
ويعلل لقيامه بذلك قائلًا: "كان أمامي ما يكفي من الوقت، وهو شيء نفيس أمكنني أن أبذله لفهم هذا المرض، واكتشاف علاجات ناجعة له".
في العام الماضي، قُبل طلبه بالالتحاق بتجربة ثورية. وفي أكتوبر من العام نفسه، زرع جراحون في مدينة لوند السويدية في دماغه خلايا عصبية متمايزة من خلايا جذعية جنينية بشرية، أملًا في أن تحل هذه الخلايا محل بعض من أنسجته التالفة في نهاية المطاف.
وهذه الدراسة، ليست إلا واحدة من أكثر من 100 تجربة إكلينيكية تستكشف في الوقت الحالي قدرة الخلايا الجذعية على تعزيز وظائف الأنسجة أو تعويض تلفها في الأمراض الموهنة أو المهددة للحياة، مثل داء السكري، والصرع ، وفشل القلب، وبعض أمراض العيون. وهي مقاربة مختلفة عن العلاجات غير المعتمدة التي تروج لها بعض العيادات الإكلينيكية المشبوهة، والتي تستخدم أنواعًا لا تتحول إلى أنسجة جديدة من الخلايا الجذعية.
أما التجارب التي تستخدم المقاربة سالفة الذكر، فهي صغيرة النطاق وتركَّز بالأساس على سلامة المرضى. إلا أنها تواجه حتى اليوم عقبات هائلة، منها صعوبة الوقوف على أنواع الخلايا الأنسب للوظائف المطلوبة والعراقيل أمام الاستغناء عن العقاقير الكابتة للمناعة التي تحول دون رفض الجسم للخلايا الجذعية لكن تعزز خطر الإصابة بعدوى.
وتمثل هذه الدفعة من التجارب الإكلينيكية نقطة تحوُل للعلاجات القائمة على الخلايا الجذعية. فاليوم، بعد عقود من البحوث المكثفة، التي فجرت أحيانًا جدلًا أخلاقيًا وسياسيًا، تُختبر على نطاق واسع فاعلية وأمان هذه العلاجات في تجديد الأنسجة. حول ذلك، يقول مارتن بيرا من مختبر جاكسون في بار هاربور في ولاية ماين الأمريكية: "مضت عجلة تقدم هذه العلاجات بسرعة مدهشة. فلم يمض سوى 26 عامًا على اكتشافنا لطريقة استزراع الخلايا الجذعية البشرية في القوارير المختبرية".
ويتوقع باحثون أن تنتقل بعض العلاجات القائمة على الخلايا الجذعية إلى حقل التجارب الإكلينيكية عن قريب. ويرون أن بعض هذه العلاجات قد يدخل في حيز ممارسات الطب العام في غضون فترة تتراوح ما بين خمس إلى عشر سنوات.
Credit:. Åsa Sjöström for Nature
العثور على خلايا أولية مناسبة
بدأت أعراض كاسي برعشة بسيطة مستمرة في أصابعه عندما كان في الرابعة والأربعين فقط من عمره. وهذه الأعراض الحركية المميزة لداء باركنسون يتسبب فيها تحلُل الخلايا العصبية المنتجة للدوبامين، المعروفة باسم «إيه 9» A9، في منطقة المادة السوداء بالدماغ. وتُعد العقاقير التي تعوِّض نقص الدومابين في هذه الحالة فعالة، لكنها تنتج آثارًا جانبية، من بينها الحركة التي لا يمكن السيطرة عليها، وبعض السلوكيات المتهورة. ومع اشتداد المرض، تضعف فاعلية هذه العقاقير وتتفاقم آثارها الجانبية.
وتستند فكرة علاج هذه الحالة بتعويض الخلايا المتحللة إلى تاريخ طويل. ففي أثناء تكوُن الجسم، تتحول الخلايا الجذعية الجنينية متعددة القدرات التي تملك القدرة على التمايُز إلى أنواع عديدة من الخلايا إلى خلايا متخصصة في الدماغ والقلب والرئة وما إلى ذلك. ونظريًا، يمكن للخلايا الجذعية المستزرعة إصلاح تلف أي أنسجة.
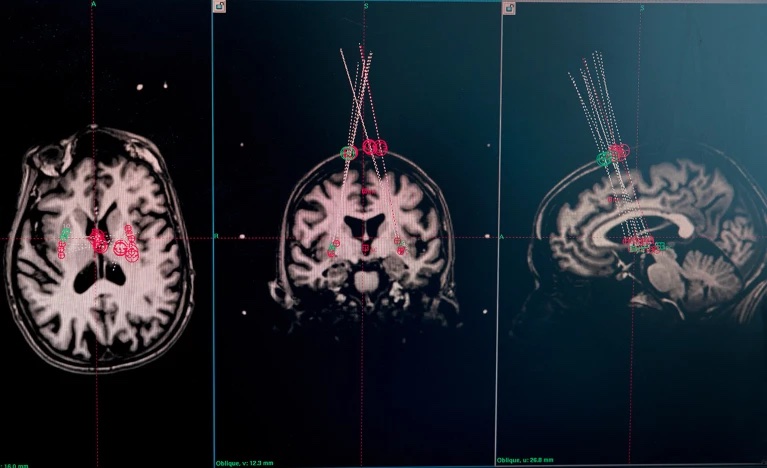
ويُعد داء «باركنسون» من الأمراض التي يمكن فيها اختبار صحة هذه النظرية. أُجريت أولى جراحات استزراع هذه الخلايا في السويد عام 1987، باستخدام خلايا عصبية نامية من أدمغة أجنة سقط حملها. إذ عُدت هذه الخلايا آنذاك المصدر الوحيد للخلايا العصبية السالفة أو الأولية غير البالغة. ومنذ ذلك الحين، خضع أكثر من 400 شخص مصابين بداء «باركنسون» لهذه الجراحة، التي تباينت نتائجها. إذ لم تعد بأي نفع على الكثيرين ممن خضعوا لها، أو كانت لها آثار موهنة للصحة. على أن حالات أخرى خضعت للجراحة شهدت تحسنًا كبيرًا إلى حد أنها لم تعد بحاجة إلى العلاج بالعقاقير الدوبامينية.
في هذا الإطار، يقول روجر باركر اختصاصي علم الأعصاب من جامعة كامبريدج بالمملكة المتحدة: "إجمالًا، أظهرت الدراسات أن هذه المقاربة قد تنجح، بل إنها قد تشكل نقطة تحول في حياة الأفراد أحيانًا. لكننا احتجنا إلى مصدر لهذه الخلايا يمكن التعويل عليه بدرجة أكبر".
فأنسجة الخلايا الجنينية قد يتعذر توحيد سلوكها، وقد تتلوث أيضًا بخلايا سالفة مُقدر لها التحوُل عند بلوغها إلى نوع غير مناسب من الخلايا. بالإضافة إلى ذلك، يعارض البعض استخدام هذه المواد لأسباب أخلاقية أو دينية. وعلى كل، كما ينوه باركر، كثيرًا ما تعذر الحصول على القدر الكافي من الخلايا الجذعية المناسبة، التي يمكن المضي في استزراعها.
لكن تحسنت فرص نجاح العلاجات التجديدية القائمة على الخلايا الجذعية، عندما أمكن اشتقاق خلايا جذعية متخصصة من مصادر يمكن التحكم فيها بدرجة أكبر، تتمثل بالأخص في الخلايا الجذعية الجنينية البشرية، والخلايا الجذعية المستحثة متعددة القدرات. والأخيرة هي خلايا تُنتج بإعادة برمجة الخلايا البالغة للعودة إلى حالتها قبل البلوغ. واليوم، يمكن بدقة وسلامة وموثوقية إنتاج أعداد كبيرة من الخلايا المتخصصة، بالقدر الكافي الذي يسمح باستخدامها في التجارب الإكلينيكية.
درست أجنيتي كيركيبي، الباحثة المتخصصة في دراسة الخلايا الجذعية من جامعة كوبنهاجن، مع فريقها البحثي المشهد على ساحة التجارب الإكلينيكية للعلاج بالخلايا الجذعية التجديدية في جميع أنحاء العالم، واعتبارًا من ديسمبر عام 2024، وقفوا على 116 تجربة معتمدة أو مكتملة من هذا النوع لعلاج طيف متنوع من الأمراض1. ووجد الفريق البحثي أن حوالي نصف هذه التجارب يستخدم الخلايا الجذعية الجنينية البشرية كمادة أولية. في حين استخدم النصف الآخر، الخلايا الجذعية المستحثة متعددة القدرات، سواء الجاهزة أو المستحدثة من الخلايا الجلدية أو الدموية للمريض نفسه لعلاج حالته. وتسعى اثنتا عشرة تجربة من هذه التجارب لعلاج داء باركنسون باستخدام خلايا منتجة للدوبامين، تُشتق من الخلايا الجذعية.

Credit:Åsa Sjöström for Nature
بصيص أمل في علاج داء باركنسون
كل من التجربة التي التحق بها كاسي (وهي تجربة يشارك في قيادتها باركر)، وتجربة أخرى أكثر تقدمًا تجريها شركة التقنيات الحيوية الكائنة في مدينة كامبريدج بولاية ماساتشوستس، «بلو روك ثيرابيوتكس» BlueRock Therapeutics، تمد المشاركين فيها بخلايا جذعية سالفة باسم «إيه 9»، مشتقة من الخلايا الجذعية الجنينية البشرية. وقد أفادت تجربة شركة «بلو روك ثيرابيوتكس» بالنتائج الأولية لعلاج من شاركوا فيها وعددهم 12 مشاركًا. فأعلنت أنه بعد عامين من تلقي المشاركين فيها للعلاج بالخلايا الجذعية، ثبت أمان هذا العلاج لدى من تلقوا الجرعة الأعلى منه. وحتى اليوم، لم تعلن أي من تجارب علاج داء باركنسون بالخلايا الجذعية عن حدوث حركة لا إرادية كأثر جانبي لهذا العلاج، وهو ما حدث في حالات العلاج بالعقاقير الدوبامينية وفي بعض التجارب التي استخدمت أنسجة جنينية.
فعلى عكس أعضاء الجسم الأخرى، مثل القلب والبنكرياس والُكلى، ثبت أن الدماغ من أكثر ما يسهل علاجه بالخلايا الجذعية من الأعضاء. فقد انفرد بمزية وهو أنه محمي إلى حد كبير من هجمات الجهاز المناعي، التي تبحث عن الأنسجة الدخيلة على الجسم وتدمرها. من هنا، يتلقى المشاركون في تجارب علاج باركنسون العلاجات الكابتة للمناعة لعام واحد فقط، يغطي الفترة التي يتعافى فيها الحاجز الدموي الدماغي من أثر جراحة استزراع الخلايا الجذعية. أما المشاركون في تجارب استزراع الخلايا الجذعية في أعضاء أخرى، فيتلقون عادة العقاقير الكابتة للمناعة لسائر حيواتهم.
كذلك يتميز الدماغ بقدرته على توفير بيئة جيدة للخلايا الجذعية. إذ تستقر فيه الخلايا «إيه 9»، في منطقة المادة السوداء بالدماغ، وتمتد منها أجزاء ناتئة إلى منطقة البطامة في مقدم الدماغ، حيث تفرز هذه الأجزاء الدوبامين. على أن جراحي الأعصاب كثيرًا ما يستزرعون الخلايا الجذعية السالفة في منطقة البطامة مباشرة، لسهولة الوصول إليها جراحيًا. كذلك يشير باركر إلى "البراعة الكبيرة" التي يتسم بها الدماغ في التأقلم مع الأنسجة الجنينية والخلايا المستزرعة في الموضع "الخطأ".
ومما يعد مدهشًا بالقدر نفسه، حسبما يضيف باركر، أن دراسة أخرى حول داء الصرع، أوضحت أن الخلايا الجذعية المستزرعة المشتقة من الخلايا الجذعية الجنينية البشرية تتكامل مع الدوائر العصبية الصحيحة في الدماغ. على سبيل المثال، في تجربة إكلينيكية أجرتها شركة التقنيات الحيوية «نيورونا ثيرابيوتكس» Neurona Therapeutics، ومقرها في مدينة سان فرانسيسكو بولاية كاليفورنيا الأمريكية، استزرع فريق من الجراحين صورًا غير مكتملة التكوين من الخلايا الدماغية المعروفة باسم الخلايا العصبية الوسيطة في أدمغة عشرة مصابين بنوع من الصرع، تعذرت السيطرة عليه بالعقاقير. وقبل تلقي العلاج، كانت نوبات الصرع لدى المشاركين في التجربة كثيرة الحدوث وموهِنة إلى حد أنه تعذر عليهم ممارسة حيواتهم دون الاتكاء على آخرين.
لكن بعد عام من استزراع الخلايا الجذعية لديهم، انعدمت تقريبًا نوبات الصرع الشديدة لدى أول شخصين تلقيا هذا العلاج، واستمر هذا التأثير لعامين بعد الجراحة. كذلك قل معدل الإصابة بنوبات الصرع بصورة ملحوظة بين غالبية المشاركين الآخرين في التجربة. وحسبما أفادت الشركة، لم تطرأ آثار جانبية أو تلف إدراكي على المشاركين في التجربة. وفي يونيو من العام الماضي، صنفت إدارة الغذاء والدواء الأمريكية العلاج على أنه من العلاجات العاجل النظر فيها، لإسراع وتيرة اعتماد الجهات التنظيمية له.
تعقيبًا على ذلك، يقول أرنولد كرايجشتاين، من جامعة كاليفورنيا في مدينة سان فرانسيسكو الأمريكية، وهو مؤسس مشارك لشركة «نيورونا ثيرابيوتكس»: "تشابهت نتائج العلاج إلى حد مذهل بين المشاركين في التجربة، رغم أن الجراحات أُجريت في مناطق مختلفة من البلد. وأضاف: "إنها نتائج موثوقة للغاية".
وتُعد العين من الأعضاء التي تتمتع بحماية جيدة من هجمات الجهاز المناعي للجسم، شأنها في ذلك شأن الدماغ. وقد وقفت كيركيبي وفريقها البحثي على 29 تجربة إكلينيكية لعلاج اعتلالات بصرية، لا سيما أنواع من التنكس البقعي المرتبط بتقدم العمر. أما الأعضاء الأخرى، فلا تتمتع بهذه المزية المناعية، وتتسبب في بعض من أصعب الأمراض العضال، مثل فشل القلب، وداء السكري من النوع الأول، الذي ينتج عن تدمير الخلايا الجزيرية المنتجة للإنسولين في البنكرياس.
Credit:Åsa Sjöström for Nature
أداء العلاجات مع الأمراض الأخرى
أُحرز تقدم أبطأ في علاج الأمراض الأخرى بالخلايا الجذعية. لكن النتائج الأولية التي بشرت بها تجربة أجرتها شركة أدوية كائنة في مدينة بوسطن الأمريكية باسم «فيرتكس للمستحضرات الدوائية» Vertex Pharmaceuticals ولَّدت دفعة من التفاؤل بفاعلية هذه الجراحات في علاج داء السكري. جاء ذلك، عندما طوَّر دوجلاس ميلتون عالم الأحياء المتخصص في دراسة الخلايا الجذعية مع فريقه البحثي أول خلايا جزيرية فعالة من خط خلايا جذعية جنينية بشرية عام 2014 في جامعة هارفارد في مدينة كامبريدج الأمريكية2. وهو اليوم يقود في شركة «فيرتكس للمستحضرات الدوائية» تجربة لعلاج عدد من المصابين بصورة جسيمة من هذا المرض، باستخدام خلايا جزيرية مسجلة الملكية، استُحدثت بالآلية نفسها (بالتمايُز عن خلايا جذعية جنينية بشرية). وتؤدي هذه الخلايا وظيفتها أينما كان الموضع الذي استُزرعت فيه من الجسم. وقد كان في هذه الحالة الكبد. ووفقًا لما صرحت به الشركة، أصبح 9 من أصل 12 مشاركًا تلقوا الجرعة الكاملة من العلاج في التجربة في غنى عن جرعات الحقن بالإنسولين، في حين أمكن لاثنين آخرين من هؤلاء المشاركين خفض جرعتهم من الإنسولين.
حول ذلك، يقول ميلتون، الذي اتجه إلى الأبحاث في هذا المجال في تسعينيات القرن الماضي، عندما وُلد له طفل مصاب بداء السكري من النوع الأول: "دهشت وسررت لأن العلاج كان فعالًا إلى هذا الحد. كما شعرت بفرح كبير عندما اكتشفت الإمكانات التي يبشر بها في علاج المرضى".
وقد ثبت أن علاج القلب بالأخص يشكل تحديًا لمجال الطب التجديدي. فهذا العضو بمنزلة مضخة معقدة كبيرة، تشكلها أنواع مختلفة من الخلايا، ويتعين إصلاح أي تلف يلحق بها موضعيًا. في هذا السياق، يُذكر أن عالمة الخلايا الجذعية كريستين ماميري من جامعة لايدن في هولندا كانت من أوائل العلماء الذين استحدثوا خلايا عضلة قلب نابضة 3 من خلايا جذعية جنينية بشرية في عام 2002. لكنها سرعان ما أدركت أن تبني استخدام هذه الخلايا في الممارسة الإكلينيكية سيحفل بالتحديات، لا سيما عندما شهدت استئصال قلب دهني مليء بالندوب في جراحة استزراع للخلايا. وهو ما تعقب عليه بقولها: "ما خطر لي آنذاك هو أننا لن نتمكن عن قريب من إصلاح عضو هكذا". من هنا، سلكت مسارًا بحثيًا جديدًا واتجهت إلى نمذجة الأمراض. لكنها تضيف أنها تقدر مثابرة من لم يتركوا هذه الساحة، بالنظر إلى وجود حوالي 64 مليون مصاب بفشل القلب حول العالم.
وممن ثابروا، تشاك موري، عالم الأحياء المتخصص في الخلايا الجذعية من كلية كيك للطب في جامعة جنوب كاليفورنيا في لوس أنجلوس. وهو يأمل بعد زهاء 30 عامًا قضاها في هذا المجال البحثي، أن يبدأ هذا العام تجربة إكلينيكية لاختبار فاعلية وجدوى حقن خلايا عضلية قلبية بالغة، مشتقة من خلايا جذعية مستحثة متعددة القدرات، في قلوب مرضى مصابين بدرجة متوسطة من فشل القلب. ويتوقع عدد من العلماء أن يكتمل تكوين هذه الخلايا عند حقنها في القلب، لتتحول بعدئذ إلى خلايا تُعيد بناء عضلة القلب، وتعزز في الوقت ذاته قدرته على النبض.
وعن الفترة التي أمضاها تشاك موري في هذا المسلك البحثي، يقول: امتلأت هذه العقود بـ"فترات مشحونة بالقلق"، بدا فيها أن هذه المقاربة قد لا تفلح على الإطلاق. كذلك ثارت تساؤلات حول موثوقية بعض الأبحاث المتعلقة باستخدام الخلايا الجذعية لعلاج القلب. وهذه الفضائح، "ربما تكون قد أعادت المجال إلى الخلف خمس سنوات"، بتعبيره.
أما علاج الكلى بالخلايا الجذعية، فهو أصعب. فبالنظر إلى البنى المعقدة التي تتميز بها الكلى، ينطوي هذا المسعى على تحديات "أكبر كثيرًا من تلك التي تدخل في علاج القلب"، بتعبير ميليسا ليتل، الرئيس التنفيذي لمركز طب الخلايا الجذعية التابع لمؤسسة «نوفو نورديسك» Novo Nordisk Foundation Center for Stem Cell Medicine، والمعروف اختصارًا باسم (reNEW)، وهو مركز بحثي بجامعة كوبنهاجن. ويتطلب التغلب على هذه التحديات تعاوُنًا بين علماء الأحياء واختصاصيي الهندسة الوراثية في مجال الخلايا الجذعية، لكن اتحادًا كهذا "لا يزال في مراحله الأولى". إلا أن الحاجة الطبية إليه ماسة: "فعدد من ينتظرون الخضوع لجراحات زرع الكلى يربو على 100 ألف شخص في الولايات المتحدة وحدها، ولا يتلقى إلا واحد من كل 4 منهم كُلية".
وفي هذا المبحث الإكلينيكي الآخذ في النمو بسرعة كبيرة، يجري أيضًا استحداث الخلايا المناعية من الخلايا الجذعية متعددة القدرات وتُستخدم لاستهداف الخلايا السرطانية. وفي الوقت الحالي، تجري ثلاثة وعشرين تجربة لاختبار فاعلية الخلايا التائية أو الخلايا القاتلة الطبيعية المشتقة من الخلايا الجذعية في علاج طيف من الأورام السرطانية، في مقاربة قد تكون أسرع وأقل تكلفة من العلاجات المناعية الخلوية المستخدمة اليوم. وتفيد تقارير أولية، بأمان هذه العلاجات وبقدرة الجسم على تحملها، وبفاعليتها الشديدة في بعض الأحيان، إذ أدت إلى خمود المرض تمامًا لدى بعض المشاركين1.
اختيار الخلايا الأنسب
فهل الخلايا الجذعية الجنينية البشرية أفضل كمصدر للعلاجات الخلوية، أم الخلايا الجذعية المستحثة متعددة القدرات؟ يبقى هذا السؤال المهم عالقًا بلا جواب. وإجابةً عنه، يقول بنجامين روبينوف من الجامعة العبرية في القدس، والذي نجح في تطوير خلايا متخصصة في إحدى التجارب الكبرى لعلاج التنكس البقعي: "من الناحية الوظيفية، ليس هناك اختلاف واضح".
استخدَمَت أولى التجارب حول العلاج بالخلايا الجذعية الخلايا الجذعية الجنينية البشرية رغم الجدل السياسي الذي يحيط باستغلال الأجنة البشرية، لأن الخلايا الجذعية المستحثة متعددة القدرات لم تكن قد استُحدثت بعد. لكن في عام 2006، ابتُكرت أولى آليات4 إعادة برمجة الخلايا. بيد أنه تجدر الإشارة إلى أنه حتى اليوم، لا يزال بعض العلماء يفضل استخدام الخلايا الجذعية الجنينية البشرية، بالنظر إلى أنها الأقل تحوُرًا بين الخلايا الجذعية متعددة القدرات. فالخلايا البالغة متعددة القدرات، على سبيل المثال، قد تؤدي إعادة برمجتها نظريًا إلى نشأة طفرات محفزة للإصابة بالسرطان في الجينوم. في هذا السياق، تقول كيركيبي، "اختيار استخدام الخلايا الجذعية المستحثة متعددة القدرات، يرفع تلقائيًا مستوى الخطورة الذي يواجهه المريض".
غير أن كثيرًا من العلماء يرون أن خطر الإصابة بالسرطان عندئذ يكون أقرب إلى الاحتمالية منه إلى الواقع. فجينومات الخلايا المعادة برمجتها يجري فحصها للتحقق من خلوها من أي طفرات خطيرة قبل استزراع هذه الخلايا. ولم تُوثق إلى اليوم حالات إصابة بالسرطان في ما أُجري من دراسات حول الخلايا المعادة برمجتها، سواء بين البشر أو الحيوانات.
وتستخدم الغالبية العظمى من الدراسات الحديثة الخلايا الجذعية المستحثة متعددة القدرات كمصدر للخلايا. ومرد ذلك في جانب منه هو أن الحساسية الأخلاقية تجاه استخدام الأجنة البشرية لا تزال كبيرة في بعض الدول. على سبيل المثال، في الولايات المتحدة، ثمة مخاوف من أن يتحول التيار السياسي فجأة إلى الهجوم على استخدام الخلايا الجذعية العلاجية المشتقة من الأجنة. في ذلك الصدد، يقول تشاك موري، الذي دفع على مدار عقدين بأن استخدام الأجنة المُجهضة لمساعدة الأفراد على قيد الحياة أفضل أخلاقيًا من التخلص منها: "التوجه السياسي له وزنه". لكن يُذكر أن موري اغتنم فرصة انتقاله من جامعة واشنطن في سياتل إلى كلية كيك للطب في أغسطس من العام الماضي للتحوُل إلى استخدام الخلايا المشتقة من الخلايا الجذعية المستحثة متعددة القدرات. ويعلل لذلك قائلًا: "بما أنه سنحت لنا الفرصة لبدء صفحة جديدة، لم أجد سببًا يدعوني إلى الاستمرار في الدفاع عن استخدام الخلايا الجذعية الجنينية".
وتبقى الحيلولة دون رفض الجسم للخلايا المستزرعة قضية ملحة أخرى. فالخطوط الخلوية غير المتخصصة المعدة سلفًا، والمتمايزة من الخلايا الجذعية الجنينية البشرية أو الخلايا الجذعية المستحثة متعددة القدرات يمكن عادة استخدامها في أي وقت، لكنها تتطلب علاجات كابتة للاستجابات المناعية. وتنتفي الحاجة إلى استخدام هذه العلاجات عند الاستعانة بخلايا مواءَمة متمايزة عن خلايا الجلد أو الدم للشخص نفسه بعد إعادة برمجتها. غير أن إنتاج مثل هذه الخلايا يُكبد تكلفة باهظة ويستغرق أسابيع عديدة. إلا أن هناك طرق أخرى تغني عن العلاجات الكابتة للمناعة. يتمثل أحدها في التحرير الجيني لهذه الخلايا بحيث تكون مستترة للجهاز المناعي. ومن الطرق الأخرى، إيواء هذه الخلايا. على سبيل المثال، في الوقت الحالي، يسعى باحثون في مجال مكافحة داء السكري إلى احتجاز الخلايا الجزيرية المستزرعة في كبسولات مصنوعة من مواد حيوية متوافقة مع الجسم، ذات نفاذية انتقائية، يمكن للجزيئات الصغيرة مثل الجلوكوز والإنسولين النفاذ عبرها، في حين تعجز الخلايا المناعية الكبيرة عن ذلك.
وفي الوقت الذي تختبر فيه فاعلية هذه العلاجات، يعكف العلماء أيضًا على توسعة وإضفاء تنوع على طاقم أدواتهم الخلوية. على سبيل المثال، لا تقف الخلايا العصبية الدوبامينية وراء كل أعراض داء «باركنسون»؛ فقد ينجم التدهور الإدراكي في هذا المرض عن تحلل خلايا عصبية تستخدم الأسيتيل كولين كناقل عصبي. من هنا، بدأ العلماء في اختبار فاعلية خلايا عصبية كتلك تتمايز عن الخلايا الجذعية.
ختامًا، من المتوقع أن يستغرق قياس الجدوى الحقيقية للخلايا الجذعية في مجال الطب التجديدي بعض الوقت. إلا أن كاسي سعيد بلعب دور في هذه المساعي. فيقول: "بما أنها أبحاث، لا تدري إلام ستؤول نتائجها. لكنني دلفت إلى غرفة العمليات دون أدنى تردد وكلي ثقة".
هذه ترجمة المقال الإنجليزي المنشور بمجلة Nature بتاريخ 20 ديسمبر عام 2024
doi:10.1038/nmiddleeast.2025.13
تواصل معنا: